Післяопераційне знеболювання в пацієнтів травматологічно-ортопедичного профілю
Як досягти оптимального післяопераційного знеболення та прискорити відновлення пацієнта після травматологічних та ортопедичних втручань згідно з чинними протоколами
Післяопераційне знеболювання в пацієнтів травматологічно-ортопедичного профілю
Після травматологічних та ортопедичних втручань із болем стикається більшість пацієнтів — майже 80% скаржаться на помірний або сильний біль. Неконтрольований післяопераційний біль не тільки значно знижує якість життя, але й може призвести до розвитку хронічного больового синдрому, уповільнення процесу відновлення та подовження реабілітації. Тому ефективне знеболення є одним з основних факторів, що забезпечують успішне післяопераційне відновлення пацієнтів1.
Механізм формування болю після травматологічно-ортопедичних втручань
Після травматологічно-ортопедичних операцій біль зазвичай має ноцицептивний характер. Цей тип болю виникає через пошкодження тканин під час втручань, що призводить до активації ноцицептивних рецепторів, які розташовані в кінцевих нервових волокнах. Звідти сигнали передаються через аферентні нейрони до спинного мозку, а потім через висхідні спиноталамічні шляхи і таламокортикальні проєкції — до вищих нейронних центрів у корі головного мозку, де інтерпретується та модулюється відчуття болю. Дальша модуляція болю відбувається в довгастому мозку, низхідних шляхах і дорсальному розі спинного мозку2.
У відповідь на ушкодження вивільняються хімічні агенти, такі як брадикінін, простагландини, серотонін, гістамін, ацетилхолін, іони калію та іони водню. Ці агенти можуть безпосередньо стимулювати або сенсибілізувати периферичні ноцицептори, що підвищує інтенсивність болю. Простагландини не активують ноцицепторів безпосередньо, але вони ефективно підвищують чутливість до інших хімічних агентів, що значно посилює передачу больових імпульсів. Це збільшує чутливість нервових закінчень до дальших больових подразників і спричиняє розвиток нейрогенного запалення, що своєю чергою посилює больову відповідь2.
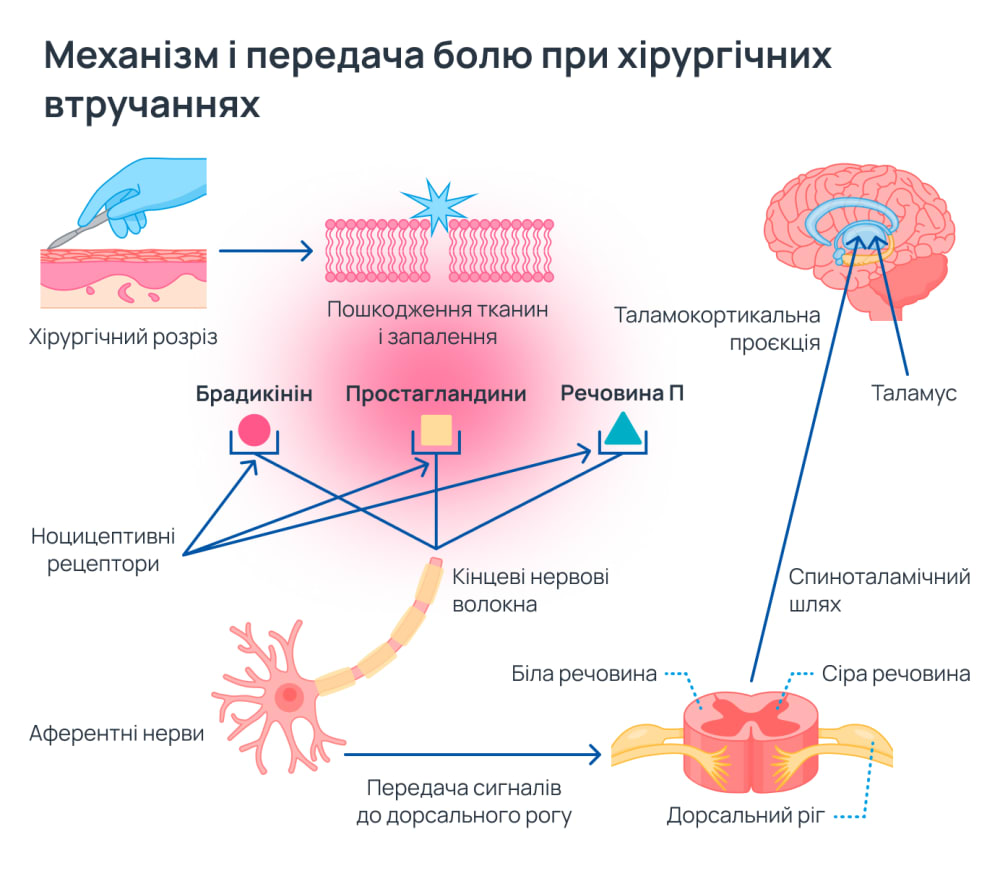
Нейрогенне запалення виникає, коли потенціали дії в активованих нейронах поширюються не тільки від периферії до центральної нервової системи, але й у зворотному напрямку. Це зумовлює вивільнення нейропептидів, таких як речовина П, яка спричиняє вазодилатацію та екстравазацію, а також стимулює подальше вивільнення брадикініну, що підвищує запальний процес2.
Якщо периферичний больовий стимул є інтенсивним і тривалим, може розвинутися вторинна гіпералгезія та центральна сенсибілізація, що створює нейробіологічну основу для тривалого болю, який пацієнти можуть відчувати навіть після загоєння тканин. Цей стан є складним для лікування і може призвести до розвитку хронічного болю2,3.
Тому є необхідність у заходах для мінімізації ноцицептивного болю у травматологічно-ортопедичних пацієнтів, що потребує використання різних підходів2. Серед основних — мультимодальний і мультидисциплінарний методи
Оптимізація післяопераційного відновлення
Протокол прискореного відновлення після хірургічного втручання ERAS — це комплексний мультидисциплінарний підхід, спрямований на покращення відновлення пацієнтів після операції. У травматологічно-ортопедичній хірургії його застосовують для скорочення тривалості госпіталізації, зменшення післяопераційного болю та зниження потреби в опіоїдних анальгетиках. Протокол ERAS охоплює всі етапи лікування — від передопераційної підготовки до інтраопераційного ведення і післяопераційного відновлення. Протоколом передбачено комплекс заходів, спрямованих на зменшення хірургічного стресу, оптимізацію анестезії, прискорення відновлення і покращення результатів лікування4.
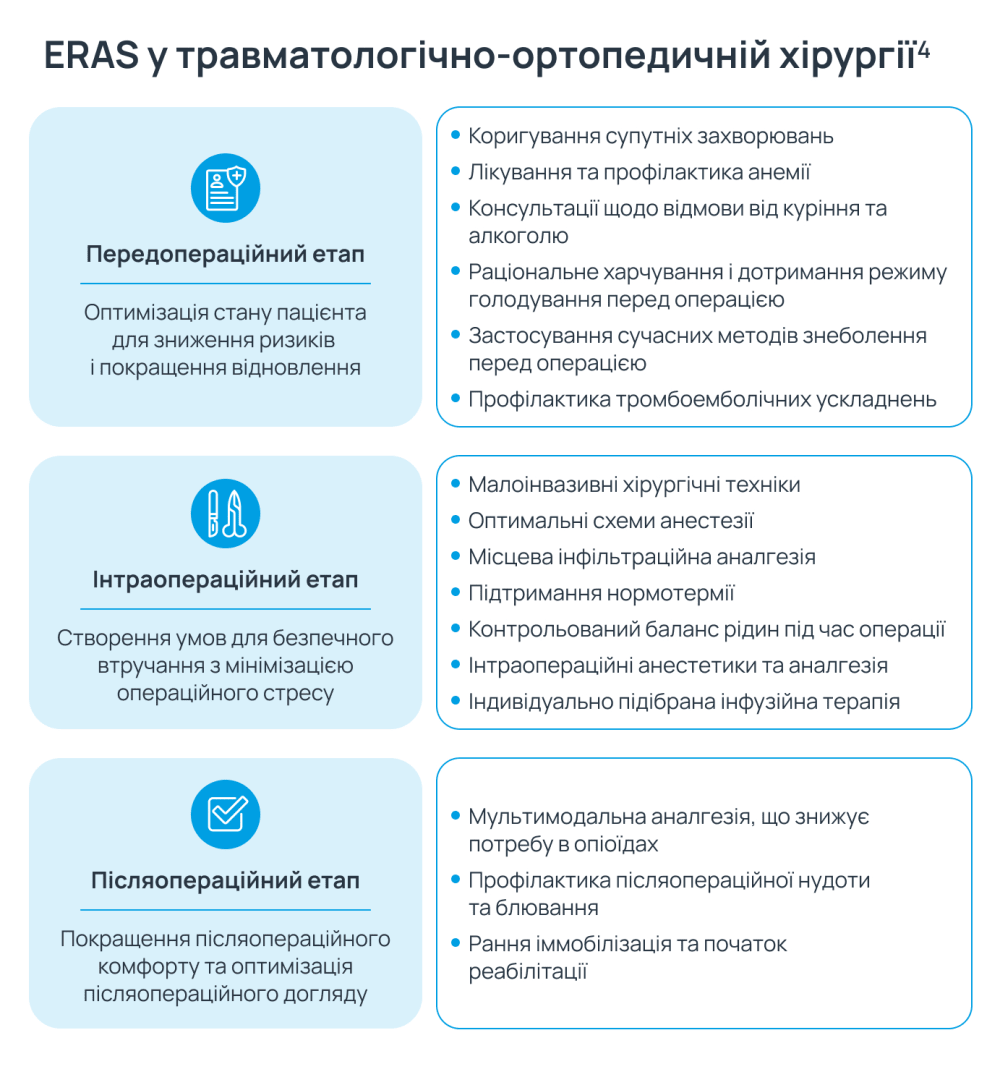
Ключовим компонентом підходу ERAS до післяопераційного відновлення є метод мультимодальної аналгезії, який є одним із найефективніших підходів для знеболення в травматологічно-ортопедичній практиці2,4
Мультимодальний підхід до лікування болю
Мультимодальна аналгезія (ММА) передбачає використання кількох методів контролю болю для досягнення ефективного знеболення та зменшення побічних ефектів, пов’язаних із застосуванням опіоїдів. Концепція ММА базується на принципі поєднання анальгетиків із різними механізмами або місцями дії, що дає змогу ефективніше контролювати біль і знижує ризик побічних ефектів завдяки зменшенню потреби в опіоїдах2.
Застосування ММА починається до операції. Важливим принципом ММА є превентивна аналгезія, яка передбачає введення знеболювальних засобів або виконання процедур ще до хірургічного розрізу. Превентивну аналгезію спрямовано на запобігання периферичній та центральній сенсибілізації, зменшення частоти гіпералгезії та інтенсивності післяопераційного болю2.
ММА при травматологічних та ортопедичних операціях включає методи, які діють на різних рівнях ноцицептивної системи2,4,5:
Системна аналгезія
- Опіоїди (морфін, фентаніл, меперидин, кодеїн)
- Парацетамол
- Нестероїдні протизапальні засоби (кеторолак, ібупрофен, парекоксиб)
- Антагоністи NMDA-рецепторів (кетамін)
- Центральні анальгетики (нефопам)
- Протисудомні засоби (габапентин, прегабалін)
- Бета-блокатори (атенолол, метопролол)
- Альфа-2-агоністи (клонідин, дексмедетомідин)
Місцеві анестетики
- Лідокаїн, мепівакаїн, хлоропрокаїн, бупівакаїн, ропівакаїн
- Глюкокортикоїди (метилпреднізолон, тріамцинолон, дексаметазон)
Нейроаксіальна аналгезія
- Спинальна
- Епідуральна
- Комбінована (спино-епідуральна)
Регіонарна аналгезія
- Блокада периферичних нервів
Місцева інфільтраційна аналгезія
Уведення анестетика безпосередньо в місце хірургічного втручання

Опіоїдні лікарські засоби залишаються частиною лікування післяопераційного болю. Проте для зменшення загальної дози опіоїдів і оптимізації післяопераційної аналгезії в сучасних протоколах знеболювання передбачають застосування неопіоїдних анальгетиків5. Серед них — нефопам, який застосовують як допоміжний засіб для зменшення потреби в опіоїдах у пацієнтів із вираженим післяопераційним болем6.
Нефопам у дозі 20 мг забезпечує знеболювальний ефект, еквівалентний 6 мг морфіну6
Застосування нефопаму як компонента ММА в пацієнтів після травматологічних і ортопедичних операцій забезпечує7:
Зниження інтенсивності больового синдрому:
→ На 23,6% у перші 6 годин після операції
→ У 1,5, 2,3 і 3,6 раза через 12, 18 і 24 години відповідно
Зниження рівня кортизолу в сироватці крові, що сприяє зменшенню післяопераційної стресової реакції
Зниження потреби в опіоїдах:
→ Середня кумулятивна доза морфіну зменшилася в 1,5 раза протягом перших 24 годин після операції
→ Загальний опіоїд-редукуючий ефект нефопаму становив 61,7%
Основні тези
Майже 80% пацієнтів після травматологічних та ортопедичних втручань відчувають помірний або сильний біль1
Після травматологічно-ортопедичних операцій біль зазвичай має ноцицептивний характер2
Протокол прискореного відновлення після хірургічного втручання ERAS — це комплексний мультидисциплінарний підхід, спрямований на покращення відновлення пацієнтів після операції. У травматологічно-ортопедичній хірургії його застосовують для скорочення тривалості госпіталізації, зменшення післяопераційного болю та зниження потреби в опіоїдних анальгетиках4
Мультимодальна аналгезія (ММА) передбачає використання кількох методів контролю болю для досягнення ефективного знеболення і зменшення побічних ефектів, пов'язаних з опіоїдами2
Для зменшення загальної дози опіоїдів і оптимізації післяопераційної аналгезії в сучасних протоколах знеболювання передбачають застосування неопіоїдних анальгетиків, наприклад нефопаму5,6
Нефопам у дозі 20 мг забезпечує знеболювальний ефект, еквівалентний 6 мг морфіну6
Післяопераційна аналгезія у складі мультимодальної аналгезії та симптоматичне лікування гострих больових станів
Симптоматичне лікування помірного чи сильного болю, включно з болем у післяопераційний період, міалгією, артралгією
Показаний для знеболювання у складі мультимодальної аналгезії, лікування гострих больових станів і запобігання післяопераційному тремтінню
ERAS (Enhanced Recovery After Surgery) — Прискорене відновлення після хірургічного втручання
ММА — мультимодальна аналгезія
- Aldanyowi S.N. Novel Techniques for Musculoskeletal Pain Management after Orthopedic Surgical Procedures: A Systematic Review. Life. 2023; 13(12):2351. DOI: https://doi.org/10.3390/life13122351
- Chunduri A., Aggarwal A.K. Multimodal Pain Management in Orthopedic Surgery. J Clin Med. 2022; 11(21):6386. DOI: 10.3390/jcm11216386
- Vadivelu N., Mitra S., Schermer E. et al. Preventive analgesia for postoperative pain control: a broader concept. Local Reg Anesth. 2014; 7:17–22. DOI: 10.2147/LRA.S62160
- García L.T.C., Ponce F.E.E.O., Esparza A.C.M. Postoperative Pain in Orthopedics. Topics in Postoperative Pain. IntechOpen. 2023. Available at: http://dx.doi.org/10.5772/intechopen.111880/ (Last access: 07.03.2025).
- Devlin J., Skrobik Y., Gélinas C. et al. Clinical Practice Guidelines for the Prevention and Management of Pain, Agitation/Sedation, Delirium, Immobility, and Sleep Disruption in Adult Patients in the ICU. Critical Care Medicine. 2018; 46(9):e825–e873. DOI: 10.1097/CCM.0000000000003299
- Шостак М.А., Крижевський В.В., Доморацький О.Е. та ін. Перспектива застосування сучасних анальгетиків центральної дії для лікування гострого післяопераційного болю в пацієнтів травматологічного профілю. Emergency Medicine (Ukraine). 2022; 18(2):87–90. DOI: 10.22141/2224-0586.18.2.2022.1480
- Шостак М.А., Доморацький О.Е. Оптимізація лікування гострого післяопераційного болю у пацієнтів травматологічно-ортопедичного профілю. Emergency Medicine (Ukraine). 2024; 20(8):759–764. DOI: https://doi.org/10.22141/2224-0586.20.8.2024.1813








