Еволюція лікування різних типів вікової макулярної дегенерації
Як змінювались підходи до лікування вікової макулярної дегенерації — від перших невдалих методів до сучасних, дієвих рішень. Дізнайтесь, які методи справді працюють і чому рання діагностика має значення.
Еволюція лікування різних типів вікової макулярної дегенерації
Авторка матеріалу
Від повної безпорадності в середині XX століття до складних біоінженерних стратегій сьогодення – історія лікування ВМД демонструє безпрецедентний прогрес. Волога форма ВМД із синоніма сліпоти перетворилася на захворювання з керованим перебігом, а профілактика сухої форми вийшла за межі вітамінних добавок. У найближчому майбутньому – ще більше тривалих, безпечних і персоналізованих підходів.
Вікова макулярна дегенерація (ВМД) є однією з провідних причин незворотної втрати центрального зору серед людей віком понад 60 років у розвинених країнах. Ураження макули — центральної ділянки сітківки, відповідальної за гостроту зору — призводить до суттєвого зниження якості життя пацієнтів, ускладнюючи читання, розпізнавання облич та виконання повсякденних завдань.

Ключові моменти в розвитку підходів до лікування вологої форми вікової макулярної дегенерації:
Ранні підходи (до 1990-х років)
Фактично у середині ХХ століття не існувало ефективного лікування ВМД, особливо її вологої форми.
1970-і
Першою експериментальною спробою було використання ксенонової фотокоагуляції → яка зарекомендувала себе, як травматичний метод із низькою ефективністю, оскільки грубий лазер часто пошкоджував здорову сітківку.
1980-ті
Перший доказово підтверджений метод лікування - лазерна коагуляція неоваскулярної мембрани згідно з результатами Macular Photocoagulation Study. У цьому знаковому дослідженні застосовували аргоновий лазер для прицільного «припалювання» хоріоїдальних мембран. Виявилося, що якщо мембрана знаходиться поза центром макули (екстрафовеальна або юкстафовеальна), лазерне руйнування патологічних судин може запобігти подальшому погіршенню зору. Через знищення неоваскулярної тканини лазером вдавалося зменшити ризик масивних крововиливів і рубцювання.
Однак лазерна терапія мала суттєві обмеження: вона була придатна лише для ~10–15% випадків, коли мембрана розташована досить далеко від центру, адже при субфовеальній локалізації лазер неминуче знищував би фовеа і центральний зір.
Навіть при успішній коагуляції часто траплялися рецидиви – нові мембрани могли зростати поруч з рубцем у 50% випадків протягом 2 років. До того ж, пацієнти не набували кращого зору – найкраще, чого досягали, це стабілізація і запобігання ще більшому падінню гостроти. Таким чином, лазерна фотокоагуляція була грубим, але на той час єдиним варіантом для певних пацієнтів. В інших випадках з субфовеальними мембранами залишалося лише спостерігати, як зір погіршується природним шляхом (нерідко до “сліпоти по макулі” – пацієнт бачив лише периферією).
Кінець 1990-х – прорив із вертепорфіном (фотодинамічна терапія): лікування першої лінії
Сутність методу полягала в активації світлочутливої речовини (вертепорфіну) лазером низької інтенсивності → пошкодження патологічних судин без руйнування фовеа.
Переваги: можливість лікувати субфовеальні ХНВМ, менший рівень пошкоджень сітківки порівняно з лазером та зберігання зору у 50% пацієнтів протягом 2 років.
Недоліки: тимчасовий ефект → потреба в повторенні кожні 3 місяці, обмежена ефективність при прихованих мембранах, метод не призводить до покращення зору.
2000-ті
Спроби хірургічного лікування - пробували видаляти хірургічно хороїдальну неоваскулярну мембрану (субмакулярна хірургія) та транслокацію сітківки (переміщення всієї макули на інше місце з більш здоровим ПЕС). На жаль, результати цих складних операцій не були кращими за нехірургічні методи. Сучасні анти-VEGF практично витіснили необхідність таких ризикованих втручань.
З 2004 року Анти-VEGF ера: справжня революція в сфері лікування вікової макулярної дегенерації.
Перший препарат – пегаптаніб (Макуджен) → уповільнення втрати зору, але обмежене покращення.
2006
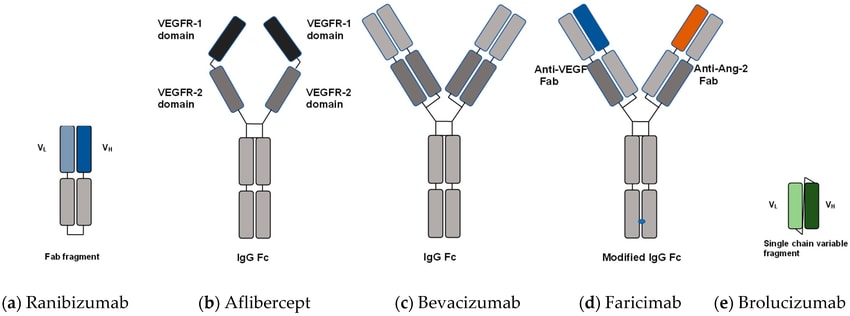
Ранібізумаб (Луцентіс): блокує всі ізоформи VEGF-A, за результатами MARINA- і ANCHOR-досліджень: у 30–40% пацієнтів покращення зору ≥3 рядки, необхідні щомісячні інтравітреальні ін’єкції. Бевацизумаб (Авастин) – off-label, дешевша альтернатива.
2011
Афліберсепт (Айлія): подовження інтервалу між ін’єкціями до 8 тижнів без втрати ефективності, застосування протоколу «treat-and-extend», підтримуюча терапія після 3–5 введень.
Результат: значне зниження частоти інвалідизуючої втрати зору у пацієнтів з ВМД.
Новітні досягнення (2010–2020-ті)
Хоч анти-VEGF терапія стала «золотим стандартом», вона вимагає частих візитів та ін’єкцій. Тому останнє десятиліття присвячене пошуку рішень для підвищення зручності та ефективності. Декілька важливих віх:
2019: бролуцизумаб (Візкью): фрагмент антитіла до VEGF, який має дуже малий розмір молекули. Завдяки цьому в кожній ін’єкції можна вводити вищу концентрацію препарату. Дослідження HAWK і HARRIER показали, що понад 50% пацієнтів на бролуцизумабі можуть утримувати ремісію з інтервалом між ін’єкціями 12 тижнів. Однак після запуску були виявлені рідкісні ускладнення – васкуліт сітківки, що дещо обмежило використання бролуцизумабу.
2021: порт-делівері система (PDS) з ранібізумабом (Susvimo): мікрорезервуар, хірургічно встановлений у стінку ока, який повільно вивільняє ранібізумаб в порожнину склоподібного тіла. Раз на 6 місяців резервуар можна перезаряджати ін’єкцією препарату. В дослідженні ARCHWAY ця система показала еквівалентну ефективність щомісячним ін’єкціям ранібізумабу. Тобто пацієнт може замість 12 ін’єкцій на рік мати одну невелику операцію і 2 дозаправки.
2022: фаріцимаб (Вабісмо) – перший біспецифічний препарат. Він нейтралізує не тільки VEGF-A, а й інший ангіогенний фактор – Ang-2. В дослідженнях TENAYA і LUCERNE фаріцимаб при ін’єкціях кожні 3–4 місяці не поступався афліберсепту кожні 2 місяці. Близько 80% пацієнтів змогли подовжити інтервал ін’єкцій до ≥12 тижнів. Це означає меншу кількість ін’єкцій при тому ж результаті. Фаріцимаб схвалений на початку 2022 р. і вже впроваджується як альтернатива монотерапії анти-VEGF.
Генна терапія перебуває на етапі клінічних досліджень: експериментальні препарати, що вводяться як вірусні вектори, змушують клітини ока продукувати власний анти-VEGF. Наприклад, RGX-314 (вектор, що кодує антитіло схоже на ранібізумаб) показав зниження потреби в ін’єкціях у перших фазах досліджень. Деякі пацієнти після однієї ін’єкції вектора не потребували традиційних ін’єкцій понад рік. Генна терапія поки не схвалена, але дослідження тривають.
Інші мішені: випробовуються інгібітори інших шляхів – наприклад, концепція блокади Ang-2 вже реалізована у фаріцимабі. Також досліджують вплив інгібіторів тирозинкіназ (OTX-TKI – імплант з препаратами, що блокують VEGF-рецептор), протеїн кінази C, комплементу (комплемент може мати роль і у вологої ВМД).
Розвиток профілактики та лікування сухої форми ВМД
Поряд із значним прогресом у лікуванні вологої (ексудативної) форми вікової макулярної дегенерації, наука приділяє дедалі більше уваги профілактиці та терапії сухої (атрофічної) форми ВМД, яка зустрічається частіше, однак на тривалому етапі також призводить до значущої втрати центрального зору.
Протягом тривалого часу ця форма захворювання вважалася майже повністю невиліковною, а основним клінічним підходом залишалося лише спостереження за прогресуванням дегенеративних змін сітківки:
Склад AREDS2-добавки (добова доза):
| Компонент | Доза | Примітки |
| Вітамін С | 500 мг | Антиоксидант |
| Вітамін Е | 400 МО (≈ 268 мг α-ТЕ) | Антиоксидант |
| Цинк (у вигляді оксиду) | 80 мг або 25 мг | Залежно від формули (знижена доза – альтернативна) |
| Мідь (у вигляді оксиду) | 2 мг | Додається для запобігання дефіциту міді, який може виникнути при високих дозах цинку |
| Лютеїн | 10 мг | Макулярний пігмент |
| Зеаксантин | 2 мг | Макулярний пігмент |
Стан терапії географічної атрофії
До 2020-х років жодного схваленого лікування географічної атрофії, найважчої форми сухої ВМД, не існувало. Цей підтип захворювання характеризується прогресуючою втратою фоторецепторів, пігментного епітелію сітківки (ПЕС) та капілярної хоріокапілярної мережі, що поступово веде до формування атрофічних зон у центрі поля зору.
Наукові дослідження останніх років встановили потенційну роль дисрегуляції комплементної системи у патогенезі сухої ВМД. Це дало поштовх до створення інгібіторів комплементу, як-от:
Пегцетакоплан (Pegcetacoplan) — інгібітор компоненту C3 комплементу, схвалений FDA у 2023 році.
Авіакеплан (Avacincaptad pegol) — інгібітор C5-компоненту, схвалений у 2023 році (торгова назва Izervay).
Обидва препарати сповільнюють прогресування площі атрофії у пацієнтів із географічною формою ВМД. Вони вводяться інтравітреально, зазвичай 1 раз на місяць, і дозволяють зменшити темп втрати фоторецепторів, хоча поки що не забезпечують зворотного відновлення зору.
- Age-Related Eye Disease Study Research Group. A randomized, placebo-controlled, clinical trial of high-dose supplementation with vitamins C and E, beta carotene, and zinc for age-related macular degeneration and vision loss: AREDS report no. 8. Arch Ophthalmol. 2001;119(10):1417–1436.
- Age-Related Eye Disease Study 2 Research Group. Lutein + zeaxanthin and omega-3 fatty acids for age-related macular degeneration: the AREDS2 randomized clinical trial. JAMA. 2013;309(19):2005–15.
- Rosenfeld PJ, Brown DM, Heier JS, Boyer DS, Kaiser PK, Chung CY, et al. Ranibizumab for neovascular age-related macular degeneration. N Engl J Med. 2006;355(14):1419–31.
- Brown DM, Kaiser PK, Michels M, Soubrane G, Heier JS, Kim RY, et al. Ranibizumab versus verteporfin for neovascular age-related macular degeneration. N Engl J Med. 2006;355(14):1432–44.
- Heier JS, Brown DM, Chong V, Korobelnik JF, Kaiser PK, Nguyen QD, et al. Intravitreal aflibercept (VEGF Trap-Eye) in wet age-related macular degeneration. Ophthalmology. 2012;119(12):2537–48.
- Dugel PU, Koh A, Ogura Y, Jaffe GJ, Schmidt-Erfurth U, Brown DM, et al. HAWK and HARRIER: phase 3, multicenter, randomized, double-masked trials of brolucizumab for neovascular age-related macular degeneration. Ophthalmology. 2020;127(1):72–84.
- Wykoff CC, Abreu F, Adamis AP, Basu K, Eichenbaum D, Haskova Z, et al. Efficacy, durability, and safety of intravitreal faricimab in neovascular age-related macular degeneration (TENAYA and LUCERNE): two randomised, double-masked, phase 3 trials. Lancet. 2022;399(10326):729–40.
- Khanani AM, Russell MW, Barakat MR, Singh RP, Wykoff CC, Capone A Jr, et al. Port delivery system with ranibizumab for neovascular AMD: the Archway phase 3 trial. Ophthalmology. 2021;128(6):825–37.
- Campochiaro PA, Wykoff CC, Brown DM, Boyer DS, Barakat MR, Singer M, et al. Durable expression of anti-VEGF Fab from AAV-RGX-314 gene therapy vector reduces treatment burden in patients with nAMD. Ophthalmol Sci. 2021;1(2):100070.
- Chew EY, Clemons TE, Agrón E, Sperduto RD, Sangiovanni JP, Kurinij N, et al. C3 inhibition with pegcetacoplan for geographic atrophy in age-related macular degeneration. N Engl J Med. 2022;387(20):1853–63.
- Curcio CA, Medeiros NE, Millican CL. Izervay (avacincaptad pegol) for geographic atrophy: a new complement C5 inhibitor. Ophthalmol Retina. 2023;7(5):413–6.
- American Academy of Ophthalmology. Age-related macular degeneration [Internet]. San Francisco: EyeWiki; [updated 2024 May 12; cited 2025 Jun 28]. Available from: https://eyewiki.aao.org/Age-related_Macular_Degeneration
- Webvision – University of Utah. Age-related macular degeneration: pathophysiology and treatment [Internet]. Salt Lake City: University of Utah Health Sciences Center; [cited 2025 Jun 28]. Available from: https://webvision.med.utah.edu/
- Schmidt-Erfurth U, Chong V, Loewenstein A, Larsen M, Souied EH, Schlingemann RO, et al. Guidelines for the management of neovascular age-related macular degeneration by the European Society of Retina Specialists (EURETINA). Br J Ophthalmol. 2014;98(9):1144–67.








